Tumor necrosis factor - alpha
반면에, 세포가 죽는 것을 억제하는 기능을 가진 인자들도 세포내에서 발견되었는데, bcl2, bclX-L, bcl-2 유사유전자가 그러한 것들이며, 이외에도 adenovirus E1B, activated T24-Ras, V-abl, baculovirus (p35, IAP), Cowpox virus crmA, A1, EB virus BHRF1, extracellular matrix, zinc, estrogen, androgens, calpain inhibiors, caspase inhibitors, tumor promoters등이 bcl-2와 같이 apoptosis를 억제함이 보고 되었다. 세포표면에는 죽음수용체(Death receptor)가 존재하는데, 세포에 죽음을 유도하는 물질들을 인지하고 수용하여 세포내로 신호전달하는 기능을 한다. 죽음수용체의 표면쪽에는 시스틴이 풍부한 domain이 노출되어 있고, 죽음을 일으키는 죽음수용체의 death domain은 세포질쪽으로 노출되어 있어서 죽음에 관한 신호전달을 하는 것으로 알려져 있다. 현재까지 규명된 죽음수용체는 CD95 (Fas or Apo1), 종양괴사인자수용체인 TNFR1 (p55 or CD120a), CAR1, death receptor3 (Apo3, WSL-1, TRAMP, LARD), death receptor 4, death receptor 5 (Apo2, TRAIL-R2, KILLER), p75 nerve growth factor (NGF) 등이 있다.
Apoptosis를 일으키는 유도인자의 하나로서 종양괴사인자 (TNF)는 세포사멸과정중 괴사(necrosis) 현상도 일으키는 것으로 알려져 있다. 세포면역물질이면서 종양을 괴사시키는 특수한 성질 때문에 지난 여러 해 동안 각 방면으로 연구되어 왔다. 종양괴사인자는 생쥐의 Myco- bacterium bovis 계통의 bacillus Calmette-Gurin (BCG)를 면역촉진제로 감작시키고, endotoxin을 처리하면 그 혈청에 특정 종양의 출혈성 괴사를 일으키는 endogenous factor가 존재하게 된다는 사실을 밝힘으로써 유래하여 종양괴사인자라 명명되었다. 이러한 종양괴사인자는 여러 가지 종양세포들에 대한 cytostatic 혹은 cytocidal효과를 나타내는 반면 정상세포에 대해서는 전혀 영향이 없는 것으로 나타났다. 종양괴사인자는 활성화된 monocyte 혹은 대식세포에 의해 생산 분비되는 것으로 알려져 있어 숙주의 면역체계에 중요한 일면을 담당하는 단백질이라 여겨지고 있다.
한편, in vitro에서도 lymphocytes를 자극하면 lymphotoxin이라고 하는 세포독성을 가지는 단백질이 생산분비되는데 종양괴사인자와 lymphotoxin은 그 아미노산 서열이 서로 비슷하고, 그 생물학적 활성이 비슷한 점 등의 유사성을 보이므로 이를 종양괴사인자-베타 (TNF-β)로 부르고 있다. 종양괴사인자-알파(TNF-α)와 종양괴사인제 베타(TNF-β)는 현재 순수하게 분리정제되어 각각의 일차구조가 밝혀지고, 일련의 클로닝연구를 통해 유전자의 일차구조도 밝혀짐으로써 서로 유사한 물질임을 알게 되었다.종양괴사인자의 유전자는 4개의 exon과 3개의 intro으로 구성되며, 157개의 아미노산을 갖는 단백질로 한 개의 intra-disulfide 결합을 갖고 있으며,생체내에는 삼합체상태로 존재한다고 보고되어 있다. 종양괴사인자 수용체 (TNF receptor)의 종양괴사인자에 대한 affinity는 세포의 민감한 정도와는 관계없이 거의 동일한 것으로 알려져 있고, 한 세포당 수백개에서 수만개의 다양한 수로 존재한다. 현재까지 종양괴사인자의 수용체가 보고 되었는데, 각각 종양괴사인자 수용체 R1 (TNF receptor R1)과 종양괴사인자 수용체 R2 (TNF receptor R2)라고 명명되어 있다. 두 수용체의 extracelluar domain는 28%의 homology를 보이나, intracellular domain은 homology가 없어서 두 수용체가 각각 다른 기능을 수행하거나 다른 신호전달기전을 갖을 가능성이 있다고 보고 있다.
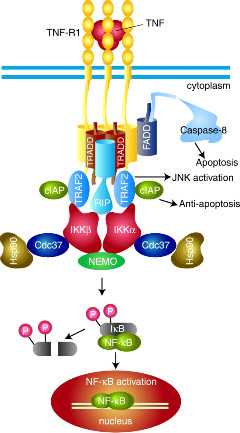
TNF는 외부항원의 감염에 의해 활성화된 T-백혈세포와 macrophage에 의해 주로 생산된다 TNF는 TNFR1에 반응하여 전사조절인자인 NF-kB와 AP-1을 활성화 시켜 염증반응과 면역기능을 변화시킬 수 있는 유전자 발현을 유도할 수 있다. 또한, 조직에 따라 TNF는 TNFR1을 통하여 세포사멸을 유도할 수도 있다. TNF는 TNFR1에 결합하는 과정에서 삼중체(trimer)를 형성하고 수용체의 다중체화를 유도한다 (그림). TNFR1은 자신의 세포질쪽 부위에 존재하는 death domain을 통하여 TRADD (TNFR-associated death domain) 라는 세포질 단백질의 death domain과 결합한다. TRADD는 활성화된 TNFR1에 여러 신호 전달 인자들이 결합할 수 있도록 하는 중간 매개체 역할을 한다. TRADD를 통해 TNFR1과 반응할 수 있는 단백질에는 TRAF2, RIP, FADD 등이 있다. TRAF2 (TNF-associated factor-2) 와 RIP (receptor-interacting protein)은 NF-kB와 JNK/AP-1을 활성화시키는 반면에 FADD는 세포사멸을 유도한다 [38, 39]. RIP은 serine-threonine 단백질 인산화 효소로서 NF-kB 또는 JNK/AP-1를 활성화시키지만 아직 그 정확한 작용기전은 명확치 않다.TRAF2와 RIP은 NIK (NF-kB-inducing kinase)를 활성화시키며, NIK는 IKK (I-kB kinase com- plex ) 를 활성화시킨다 [40]. IKK는 I-kB(inhibitor of kB)를 인 산화시켜 I-kB의 분해를 촉진시킴으로써, NF-kB가 핵내로 이동하여 여러 유전자들의 전사를 유도시킬 수 있도록 한다. FADD는 TNFR1-TRADD 복합체와 결합하여 caspase-8을 활성화시킴으로써 세포사멸을 유도한다
TNF (종양괴사인자)는 매우 다양한 생리활성을 나타내는데, 현재까지 알려진 중요한 작용만도 pro-inflammatory agent, antiparasitic agent, immunomodulator, cachectin, fibroblast growth factor, antiviral agent, 그리고 normal tissue remodeling의 mediator과 같은 여러 가지 기능이 알려져 있다. 이것의 생리적 작용기작경로에 관란 경로는 여러 연구팀에서 진행되고 있는데, 종양괴사인자가 수용체에 결합하게 되면 phosphatidylcholine- specific phospholipase C와 acidic, neutral spingomyelinase를 활성화시켜 ceramide를 생성시키고, ceramide는 proline- directed kinase (CAPK, MAPK)를 활성화시킨다. 이어 이것들에 의해 phospho- lipase A2가 방출되고, phospholipase A2는 arachidonic acid를 생성시켜 대사과정에서 산소라디칼 (oxygen radical)이 형성되고 이들의 공격에 의해 세포가 독성을 일으키는 것으로 추측되고 있다. 이와 같이 종양괴사인자는 세포에 손상을 줄 지질의 과산화를 야기시킬 뿐만 아니라 다른 유해활성산소를 생성시키는 여러효소의 생성을 촉진시킨다는 연구결과가 있다. |
또한 prostaglandins과 leukotrienes같은 pro- inflammatory 매개체의 생성에 의한 세포손상을 일으킨다. 종양괴사인자는 해당과정의 당대사의 급격한 증가를 일으킨다. 그러나 종양괴사인자에 의한 미토콘드리아의 에너지 생성기능의 상실을 보완하기 위해서 당대사가 증가하는 것인지, 종양과사인자에 의해 당대사가 급격히 증가하여서 세포내의 에너지가 과도하게 소모되고 세포의 활성도가 감소하였는지는 명확히 규명되지 않았다.
한편, 최근 몇 년 동안 생물체의 특정조직세포수를 결정지우고 암세포의 유발의 원인을 찯는데 있어서 apoptosis에 관한 연구가 차지하는 비중이 커지고 있다. 암세포에 관한 연구는 ras, myc, erb, src와 같은 여러 암유전자를 중심으로 주로 진행되었는데, 또 다른 암유전자의 하나로서 최근에 발견된 bcl-2는 이제까지 알려진 암유전자와는 달리 세포가 죽어가는 과정을 저지하는 특이한 기능을 지니는 것으로 알려져 있다. 그러므로, bcl-2에 대한 연구는 종양학적인 측면에서 관심의 초점이 되고 있다. 이와 더불어 세포의 죽는 기작에 대한 연구는 종양학적 측면뿐만 아니라, 더 이상 분열하지 않는 신경세포 분화의 연구측면에서도 관심이 되고 있다. Bcl-2는 B cell lymphoma/Leukemia-2의 약자로서, malignant B lymphoma에서 발견되었고 bcl-2 유전자가 염색체의 정상위치 (18q21)에서 14q42로 옮겨감으로써 증폭 발현되는 것으로 알려져 있다. bcl-2는 bcl-2-α와 bcl-2-β로 나뉘며, glycosylation과 phosphorylation 되어 있다. bcl-2의 ser70 residue가 인산화되면 세포생존에 관여하는기능이상실되기 때문에 인산화에 의해 그 기능이 조절되리라 보며, 인산화에는 Jun kinase와 p38 kinase가 관여한다고 예상되고 있다. 그리고 bcl-2의 half time은 10시간정도이며, 24-26kDa의 크기를 지녔고, C-terminal에 19개의 소수성 아미노산에 의해 막에 고정되어 bcl-2가 세포질쪽으로 노출되는 것으로 알려져 있다. 특히 human bcl-2 유전자는 3개의 exon과 225kb되는 몇 개의 intron을 지닌 큰 유전자에 속하며, mRNA전사과정에서 그발현이 조절되는 것으로 알려져 있다. 넓은 의미에서 본 bcl-2 family에는 세포의 생존에 관여하는 bcl-2 subfamily와 세포사멸에 관여하는 Bax subfamily와 BH3 subfamily가 있다. bcl-2 subfamily에는 Bcl-2, Bcl-XL, Bcl-w들을 비롯한 12종류가 있으며, Bax subfamily에는 Bax, Bak, Bok가 속하며, BH3 subfamily에는 Bad를 비롯한 8종류의 단백질이 알려져 있다. 이들은 BH1 ∼BH4의 4개의 공통된 domain을 갖고 있으며, Bax subfamily와 BH3 subfamily는 BH3 domain내의 9∼16rodml 잔기의 death ligand를 bcl-2 subfamily와 다르게 지님으로써 세포생존이 아닌 세포사멸의 기능을 나타내는 것으로 알려져 있다. Bcl-2의 세포내에서의 존재위치는 미토콘드리아와 핵막, endoplasmic reticulum인 것으로 알려져 있고 기능은 명확하게 규명되지 않았으나, 항산화제로서의 역할, 지질과산화의 저지, 활성 유해 산소 생성의 저지, 핵과 미토콘드리아내로의 Ca2+유입저지, caspase활성화의 저지, cytochrome C의 유출저지 등의 여러효과를 나타낸다고 보고되어 있다. 미토콘드리아는 세포죽음과정중 apoptosis와 necrosis의 두 과정에 모두 관여하는 것으로 보여지고 있는데, 대부분의 bcl-2가 미토콘드리아에 분포하고 있어서 , 미토콘드리아의 기능을 여러측면에서 조절하는 것으로 보여지고 있다.
'건강' 카테고리의 다른 글
| 류마티스성 다발근통(Polymyalgia rheumatica) (0) | 2012.06.25 |
|---|---|
| 복합부위통증증후군 (type I) - 근골격 (0) | 2012.06.22 |
| 인터루킨(IL) (0) | 2012.06.22 |
| 강직성 척추염(Ankylosing Spondylitis) (0) | 2012.06.22 |
| 건선 psoriasis (0) | 2012.06.22 |